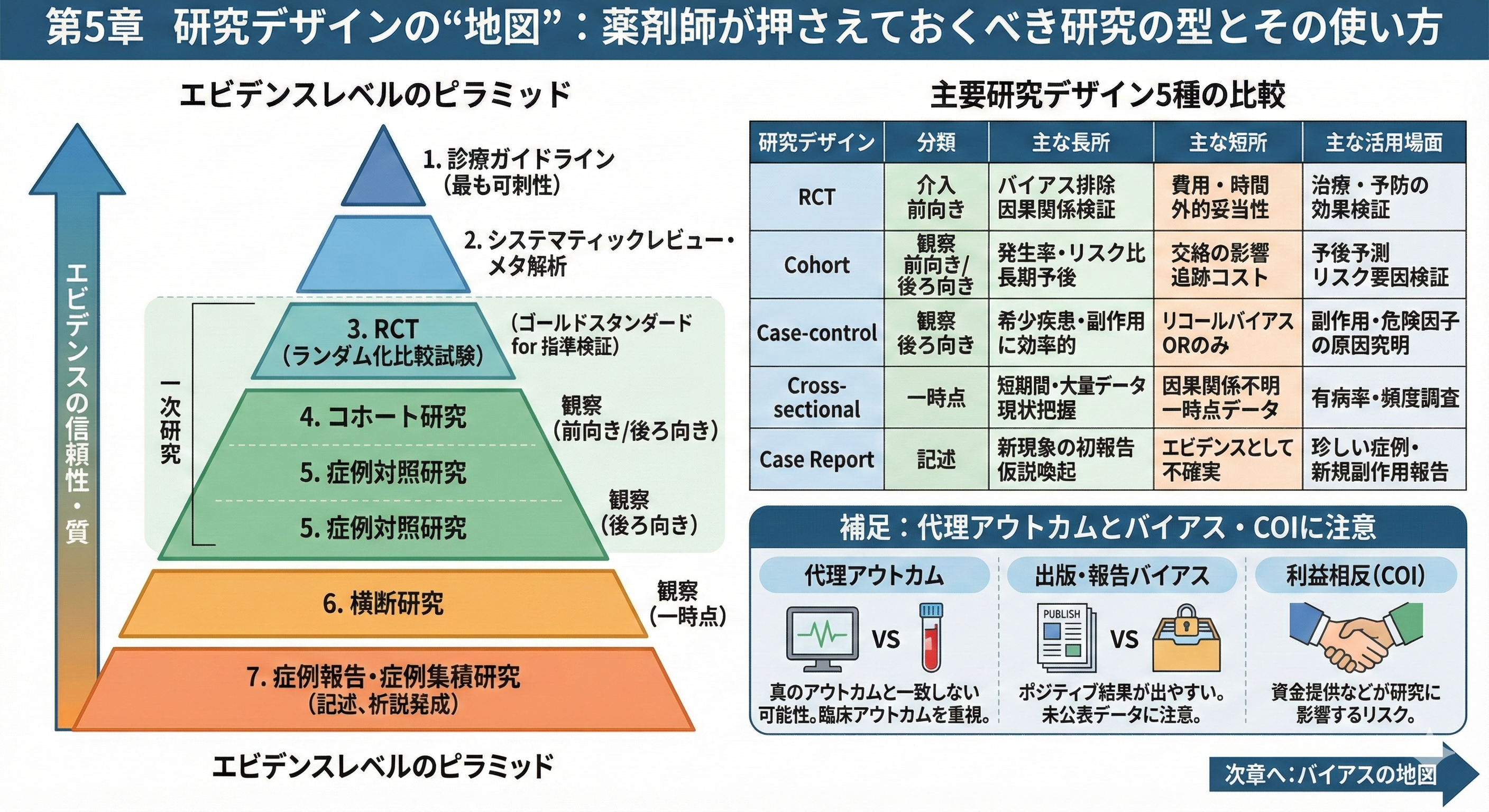
第1~4章でEBM(Evidence-Based Medicine)の意義や基本ステップについて学んできました。本章では、エビデンスを生み出す「研究デザイン」の種類とそれぞれの強み・限界を整理し、薬剤師として論文を読む際に知っておきたいポイントを解説します。研究の質や得られるエビデンスの信頼性は研究デザインによって大きく異なり、いわゆるエビデンスレベルの差にも現れます。一般にエビデンスレベルは高い方から「診療ガイドライン」「システマティックレビュー(メタ解析)」「RCT(無作為化比較試験)」「コホート研究」「症例対照研究(ケースコントロール研究)」「症例集積研究(ケースシリーズ)」「症例報告」と位置づけられます[1]。つまりガイドラインやレビューが最も信頼度が高く、RCTが一次研究としては最も信頼性が高いデザインで、その下に観察研究、さらに下に症例報告などが位置します。では、それぞれの研究デザインの特徴と活用場面を見ていきましょう。
ランダム化比較試験(Randomized Controlled Trial, RCT)
特徴: 介入研究(実験研究)の代表であり、参加者を無作為に介入群と対照群に割り付けて比較する試験デザインです。無作為(ランダム)割り付けによって年齢や性別など背景因子の偏りをできるだけなくし、公平な比較条件を作ります[2]。多くの場合前向き(プロスペクティブ)に設計され、介入以外の条件を同じにして経過を追うことで、因果関係をもっとも確実に評価できる方法です。治療や予防策の有効性を検証する際に「ゴールドスタンダード」とされ、エビデンスの信頼性が最も高い手法です。
長所: バイアス(偏り)の排除に優れ、介入の効果を客観的に評価できます[2]。適切に無作為化と盲検化(マスキング)を行えば、交絡因子の影響や測定者・参加者の先入観(情報バイアス)を最小化でき、高い内部妥当性(結果の信頼性)を確保できます。また、介入による利益と有害事象の因果関係を直接検証できる点も強みです。
限界: 実施には時間・費用・労力がかかり、対象者も厳密な基準で選ばれるため、結果の外的妥当性(一般の患者への当てはまり)に注意が必要です。倫理的・実践的理由でRCTができない場合も多く、例えば明らかに有害な曝露を無作為割り付けすることはできません。また、試験が小規模だと希少な有害事象の検出力が低い、追跡脱落が多いと結果の信頼性が下がる(追跡バイアス)といった限界もあります。
代表的なバイアス: 無作為化により選択バイアスは抑えられますが、盲検化されていないRCTでは治療への期待や評価者の先入観によるパフォーマンスバイアス・検出バイアスが生じえます。また、長期追跡が必要なRCTでは脱落(フォローアップ不良)による追跡バイアスも問題になります。
EBM実践での活用場面: 主に「治療(介入)の効果」を検証する疑問に適します。例えば新薬や新しい治療法が従来より有効かを調べる際はRCTのエビデンスが信頼性最⾼です[3]。予防医療(ワクチンや生活習慣介入など)の効果検証にも用いられます。一方、安全性に関する稀な有害事象の評価にはRCTは不向きで、その場合は後述の観察研究が活躍します。
コホート研究(Cohort study)
特徴: 観察研究の一種で、ある特性や曝露因子を持つ群(曝露群)と持たない群(非曝露群)を一定期間追跡し、将来のアウトカム発生率を比較するデザインです[4]。典型的には前向き(プロスペクティブ)に設定され、ある時点から将来に向けて追跡調査を行います(前向きコホート研究[4])。患者を直接介入せず観察するため倫理的ハードルが低く、介入研究が難しい場合にも実施可能です。また、過去のカルテ等を用いてアウトカム発生を遡って調べる後ろ向きコホート研究もあります。
長所: 時間の経過に沿って因果関係を検討でき、発生率・リスク比など疫学的指標を算出できます。複数のアウトカムを同時に観察できる柔軟性もあり、予後予測やリスク要因の特定に有用です。前向きデザインではデータの質が比較的高く、バイアスが少ない傾向にあります。例えば薬剤の長期有害事象や疾患の自然経過を調べるのに適しています。
限界: 無作為化されないため背景因子の偏り(交絡)のリスクがあります[5]。大規模で長期の追跡が必要な場合、時間とコストがかかり、追跡ロスが発生する可能性もあります。また、アウトカムが稀な場合は必要な参加者数が膨大になり非現実的です。後ろ向きコホートではデータの欠損や質のばらつきにより情報バイアスが入りやすくなります。
代表的なバイアス: 交絡バイアスが最大の注意点です。例えば「適応の交絡(Confounding by Indication)」(治療群と対照群で患者背景が異なることによるバイアス)や、追跡期間中の分析で生じる「不死時間バイアス(Immortal time bias)」などが知られています[6]。適切な交絡因子の調整や設計上の工夫(マッチング、new userデザイン等)が求められます。
EBM実践での活用場面: 「予後の見通し」や「リスク因子の検証」「有害事象の発生率評価」といった疑問に適しています。例えば薬剤Xを服用した患者の5年後の生存率(予後)を知りたい場合や、ある生活習慣が疾病リスクを高めるか調べる場合にコホート研究のエビデンスが活用されます。また、治療介入の倫理的困難な領域(喫煙の害など)ではコホート研究が重要な根拠となります[3]。
症例対照研究(Case-control study)
特徴: 観察研究の一種で、疾患やアウトカムが「起こった人」(症例)と「起こっていない人」(対照)をそれぞれ集め、過去にさかのぼって両者の曝露状況を比較するデザインです[7]。典型的に後ろ向き(レトロスペクティブ)に行われ、過去の曝露要因の有無を調査してアウトカムとの関連を統計的に評価します。直接リスクを測定する代わりに「オッズ比」で関連性を示すのが一般的で、まれな疾患や発生まで時間がかかるアウトカムの原因探索に適した手法です。
長所: 患者の登録が「アウトカム発生の有無」に基づくため、まれな疾患や副作用でも効率的に研究可能です。必要な症例数がコホート研究より少なくて済み、費用や時間を節約できます[8]。既存の記録やデータベースを活用できる場合は、新規データ収集の手間も小さく、比較的迅速に結果が得られる利点があります。
限界: 回想に頼るデータ収集では情報の正確性に限界があり、リコールバイアス(例:患者が過去の曝露を正確に覚えていない)が問題になります。また対照群の選定方法によって結果が大きく左右される選択バイアスのリスクも高いです。さらに、発生率やリスク比を直接求められず、オッズ比が近似となる点や、因果関係の方向(時間的前後関係)が不明確になりやすい点にも注意が必要です[9]。
代表的なバイアス: リコールバイアスと選択バイアスが代表例です。症例対照研究では、症例の方が対照よりも過去の曝露を詳しく報告しがちであったり、対照の選び方によって集団全体を代表していなかったりすることでバイアスが生じます。また、交絡因子による歪みもありえますが、症例対照研究では統計解析時にマッチングや多変量解析で交絡調整を行うことが一般的です。
EBM実践での活用場面: 「原因と結果の探索」に強みを発揮し、特に有害事象の原因究明や危険因子の同定に適しています。例えば新薬Yの服用者で重篤な副作用Zが発生した症例群を集め、発生しなかった対照群と比較して薬剤Yとの関連を調べる、といった場面です。疫学的な因果推論の初期段階や、希少疾患の原因究明では症例対照研究のエビデンスが貴重な手がかりとなります。
横断研究(Cross-sectional study)
特徴: ある一時点で集団を観察し、曝露要因(危険因子など)と疾患やアウトカムの有無を同時に測定する記述的研究デザインです[10]。縦断的(コホートのように追跡する)ではなく調査時点のスナップショットであり、得られる指標は有病割合(prevalence)やその時点での曝露とアウトカムの関連性です[10]。アンケート調査や横断的な疫学調査によって集めたデータを解析し、集団の特徴や要因間の相関を明らかにします。
長所: 時間とコストの効率が良く、一度に多くの対象者から複数の情報を収集できます[11]。追跡調査が不要なため脱落(ドロップアウト)の心配がなく、比較的迅速に研究を完了できます。疾病の有病率を把握したり、医療利用実態の調査を行うのに適しており、現状をマッピングするのに有用です。
限界: 因果関係の推定には不向きで、どちらが原因でどちらが結果か(時間的な前後関係)が判別できません[9]。曝露とアウトカムの関連が観察されても、それが因果関係なのか第三の要因による交絡かは判断困難です。また一時点のデータであるため、発生率やリスクの推移を見ることはできません。横断研究だけで「この因子が原因である」と結論付けることはできず、仮説生成までが主な役割となります。
代表的なバイアス: 横断研究では対象集団の選び方による選択バイアスが問題になることがあります。例えば特定の施設で調査した場合、その集団が母集団を偏って代表している可能性があります。また、測定が一時点限りであるため一部の情報が不足してしまう(例えば季節変動する要因を見逃す)などの偏りもありえます。ただし、基本的には介入を加えない観察研究のため、情報収集過程での測定バイアスは比較的少ないといえます。
EBM実践での活用場面: 「頻度や分布の把握」に適したデザインです。たとえばある副作用の有病率(頻度)を知りたい場合や、地域住民の健康習慣と特定疾患の有病率の関係を調査する場合に横断研究が用いられます。診断精度の検証(新しい検査と既存の基準検査を同時に施行し結果を比較する研究)も横断研究に分類できます。横断研究は因果の証明には至りませんが、現状を俯瞰して問題提起を行うステップとして重要です。
症例報告(Case report)
特徴: 単一または少数の症例(患者例)について詳細に経過や所見を記述する報告で、研究デザインとしては最も記述的・探索的なものです[12]。複数例をまとめたものは症例集積研究(ケースシリーズ)と呼ばれますが、基本的に対照群を持たず、ある患者に起きた現象を医学的に共有するための報告です。通常は後ろ向きに観察された事実をまとめる形で、仮説生成の出発点として位置づけられます。
長所: 珍しい症例や新しい副作用の最初の発見につながるなど、医療の知見を広げる上で重要な役割を果たします。例えば今まで報告のない薬の有害事象を世界で初めて提示するのは症例報告です。また執筆者の考察によって臨床推論や病態理解が深まることもあり、医療者の教育にも資する側面があります[13]。患者背景や治療経過を詳細に示すことで、他の医療者が似た状況に遭遇した際の参考情報となるメリットもあります。
限界: 対照がなく症例数も少ないため、それが偶然の出来事か一般化できる知見か判別できないという根本的限界があります[14]。因果関係の推定や頻度の推定はできず、エビデンスレベルは非常に低いと位置づけられます。また、インパクトのある症例のみが報告されやすい出版バイアスも存在し、世に出ている症例報告は氷山の一角に過ぎない可能性があります。したがって症例報告から得られた示唆は仮説として捉え、より高次の研究(観察研究やRCT)での検証が必要です。
代表的なバイアス: 主に出版バイアスや報告バイアスが挙げられます。印象的な症例ほど報告されやすく、ありふれた否定的な所見は報告されない傾向があります。利益相反(COI)によって都合の良い症例のみ報告する、といった偏りも完全には否定できません。そのため文献を読む際には「こうした報告がある一方で、報告されていない同様の事例が存在するかもしれない」という視点が求められます。
EBM実践での活用場面: 症例報告自体はエビデンスの確からしさでは最下位に位置しますが、新たな知見の端緒として重要です。日常業務でも、例えば「この薬で珍しい症状が出た」という経験があれば症例報告を調べて類似例がないか確認する価値があります。症例報告で提起された疑い(例えば新たな副作用の可能性)は、その後より大規模な研究につなげて検証されることでEBMの循環に組み込まれていきます。
主要研究デザイン5種の比較を以下にまとめます。
| 研究デザイン | 分類(観察/介入・時間軸) | 主な長所(メリット) | 主な短所(デメリット) | 主な活用場面・疑問例 |
|---|---|---|---|---|
| RCT(無作為化比較試験) | 介入研究(前向き) | バイアスを抑制し因果関係を厳密に検証できる | 費用・時間がかかる、対象が限定され外的妥当性に注意 | 治療や予防の効果検証(新薬Aは従来薬Bより有効か?) |
| コホート研究 | 観察研究(前向き/※後ろ向きも可) | 発生率やリスク比を算出でき長期予後を評価可能 | 無作為化でないため交絡因子の影響を受けうる、追跡に時間・コスト要 | 予後予測、リスク要因の検証(○年後の生存率は?〇〇要因で発症増加?) |
| 症例対照研究 | 観察研究(後ろ向き) | 希少疾患や副作用の原因探索に効率的・迅速 | 過去情報の精度に限界(リコールバイアス)、発生率不明でOR推定のみ | 副作用や危険因子の原因究明(副作用Aの要因として薬Bの関与は?) |
| 横断研究 | 観察研究(一時点) | 短期間で大量データ収集、現状把握に有用 | 因果関係は不明、データが一時点限りで動態不明 | 有病率・頻度調査、診断精度の評価(地域の疾病有病率は?) |
| 症例報告 | 観察(記述的・単例) | 新たな現象の初報告により仮説喚起 | エビデンスとしては最も不確実で一般化不可 | 珍しい症例・新規副作用の報告(薬Xで初めて報告された症状Y) |
※表中「OR」はオッズ比(odds ratio)のこと。
補足: 代理アウトカムと出版バイアス・COIにも注意
研究デザインそのものとは別に、結果として測定しているアウトカムの種類にも注意が必要です。論文によっては患者にとって本当に重要な臨床アウトカムではなく、代理アウトカム(サロゲート指標)を用いて効果を評価している場合があります。例えば「心筋梗塞や死亡の発生(臨床アウトカム)」の代わりに「コレステロール値の変化(代理アウトカム)」で薬剤効果を判断するといったケースです。代理アウトカムは必ずしも患者にとって意味のある結果と一致しないことがあり[15]、EBMの実践では可能な限り臨床アウトカムを重視して論文を評価する必要があります。
また、出版バイアス(publication bias)や報告バイアス(reporting bias)にも気を配りましょう。一般に、ポジティブな結果が得られた研究ほど論文として世に出やすく、ネガティブな結果は未公表に終わりやすい傾向があります[16]。製薬企業がスポンサーの試験では都合の悪い結果が公開されなかったり、論文中で有利な結果ばかり強調され不利なデータは言及が少ないといった偏りも指摘されています[16]。さらに研究者や著者が経済的利害関係を持つ場合(企業からの資金提供や株式保有など)、利益相反(COI: Conflict of Interest)が研究のデザイン・解釈に影響を及ぼすリスクもあります[17][18]。したがって論文を読む際には、研究デザイン上の質だけでなく「主要アウトカムは適切か(代理指標のみになっていないか)」「登録されながら未公開の試験結果はないか」「著者に開示されたCOIはないか」といった点も確認し、公表されたエビデンスを鵜呑みにしすぎない姿勢が大切です。
最後に、次章では「バイアスの地図」として研究デザインごとに注意すべきバイアスをさらに詳しく整理します。本章で挙げたように、ランダム化比較試験であっても盲検化不足による情報バイアスや追跡脱落による選別バイアスが起こりえますし、観察研究では交絡調整漏れや選択バイアスの入り込みが常に問題となります。各デザインの特性に応じて生じやすい選択バイアス・情報バイアス・交絡の例をマッピングし、エビデンスを批判的に読み解く視点を養っていきましょう。[1][2][5][6][3][8][9][10][11][9][13][14][15][16][17][18]
参考文献
- [1] [2] [4] [7] [12] 研究デザインの種類とエビデンスレベル | セラピストプラス | 医療介護・リハビリ・療法士のお役立ち情報 https://co-medical.mynavi.jp/contents/therapistplus/kokushi/drill/5074/
- [3] 第4章 EBM 5ステップを薬剤師業務に翻訳する.docx file://file_0000000043a871fab222ec6231c45c2e
- [5] [6] コホート研究 Cohort study | 日本薬剤疫学会 https://www.jspe.jp/learn/research-design/ohort-study/
- [8] ケース・コントロール研究 Case-control study | 日本薬剤疫学会 https://www.jspe.jp/learn/research-design/ase-control-study/
- [9] [10] [11] 横断研究 Cross-sectional study | 日本薬剤疫学会 https://www.jspe.jp/learn/research-design/cross-sectional-study/
- [13] 保健医療科学.2020;69(3) https://www.niph.go.jp/journal/data/69-3/202069030005.pdf
- [14] 健康を決める力:ヘルスリテラシーを身につける http://www.healthliteracy.jp/shinrai/post_3.html
- [15] PICOで気を付けるべき2つのアウトカム - | BRAIN | 東京都世田谷区の自費リハビリ施設BRAIN〖脳卒中専門〗 https://brain-lab.net/evidence/ebp-basic/1-5/
- [16] [17] [18] 利益相反(COI)指針とその運用に関するQ & A | 日本内科学会について | 日本内科学会 https://www.naika.or.jp/jigyo_top/coi/faqtop/